根據中心原子的價層電子對數(σ鍵數+孤電子對數),確定雜化類型:2對為sp,3對為sp?,4對為sp?,5對為sp?d,6對為sp?d?。
-
-
COCl2中的C與甲醛相同, 中間都是羰基,為sp2雜化。
-
1
-
原子的孤對電子數的確定,依據能量最低原理畫出電子排布圖,就可以確定。
分子的中心原子上的孤對電子數的確定,中心原子上的孤對電子對數=(A–xB)÷2
式中A為中心原子的價電子數,對于主族元素來說,價電子數等于原子的最外層電子數;x為中心原子結合的原子數;B為與中心原子結合的原子最多能接受的電子數,氫為1,其他原子為“8減該原子的價電子數”。
對于陽離子來說碧做,A為中心原子的價電子數減去離子的電荷數,x和B的計算方法不變。對于陰離子來說,A為中心原子的價電子數加上離子的電子數(絕對值),x和B的計算方法也不變。
另外,當氧原子、硫原子非中心原子時,其價電子數為0。
孤對電子在分子中的存在和分配影響分子的形狀、偶極矩、鍵長、鍵能等,對輕原子組成的分子影響尤為顯著。路易斯堿的堿性,配體通過配位原子與中心體的鍵合,親核反應的發生等均通過孤對電子。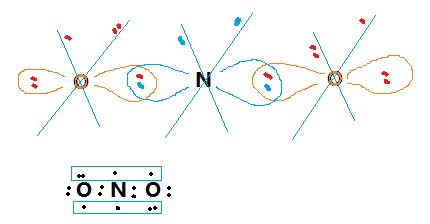
擴展資料:
價層電子對互斥理論的基礎是,分子或離子的幾何構型主要決定于與中心原子相關的電子對之間的排斥作用。該電子對既可以是成鍵的,也可以是沒有成鍵的(叫做孤對電子)。只有中心原子的價層電子才能夠對分子的形狀產生有意義的影響。
分子中電子對間的排斥的三種情況為:孤對電子悔埋衡間的排斥(孤-孤排斥);孤對電子和成鍵電子對之間的液差排斥(孤-成排斥);成鍵電子對之間的排斥(成-成排斥)。分子會盡力避免這些排斥來保持穩定。
當排斥不能避免時,整個分子傾向于形成排斥最弱的結構(與理想形狀有最小差異的方式)。孤對電子間的排斥被認為大于孤對電子和成鍵電子對之間的排斥,后者又大于成鍵電子對之間的排斥。
因此,分子更傾向于最弱的成-成排斥。配體較多的分子中,電子對間甚至無法保持90°的夾角,因此它們的電子對更傾向于分布在多個平面上。
參考資料來源:百度百科--孤對電子
-
判斷雜化類型,有個簡單的方法,即是看中心原子的價層電子數,加上周圍原子數目,然后除以2,得到的數如果是2,就是SP雜化,如果是3即是SP2,如果是4即是SP3等。。
如CH4,中心原子C的價層電子數位4,加上周圍原子數4得8,除以2為4,所以CH4是SP3雜化。四面體結構
再如SiCl4,(4 +4)/2=4 SP3雜化,正四面體結構
PH3(5 + 3)/2=4,是sp3雜化。三角錐結構。。
